基于GC-MS技术的过氧化氢诱导睾丸支持细胞损伤的代谢组学研究毕业论文
2020-06-19 22:22:38
摘 要
目的:基于GC-MS的代谢组学方法研究过氧化氢诱导睾丸支持细胞氧化应激损伤机制。
方法:用一定浓度梯度的H2O2诱导TM4细胞发生氧化应激反应,采用MTT实验检测细胞存活率、AnnexinV-FITC/PI双染细胞-流式细胞检测术检测细胞凋亡率、ROS检测仪测定了胞内ROS水平,成功建立了TM4细胞的损伤模型。建立验证GC-MS方法学并应用于TM4细胞代谢物的检测,为了分析代谢物之间的相关性,我们运用主成分分析(PCA)、偏最小二乘-判别分析法(PLS-DA)对数据进行建模。
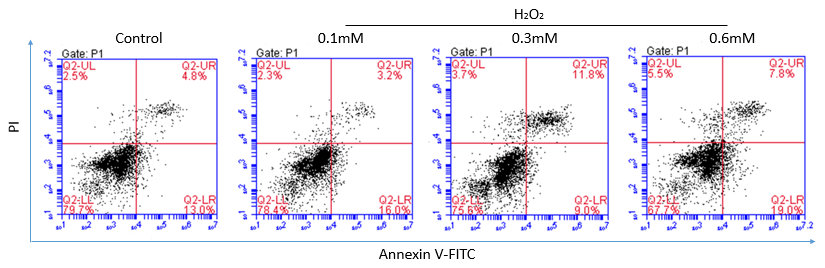
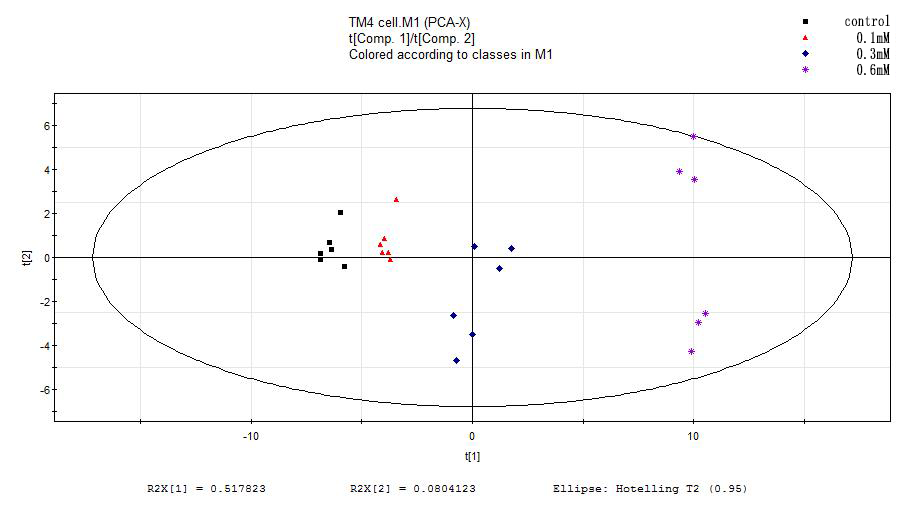
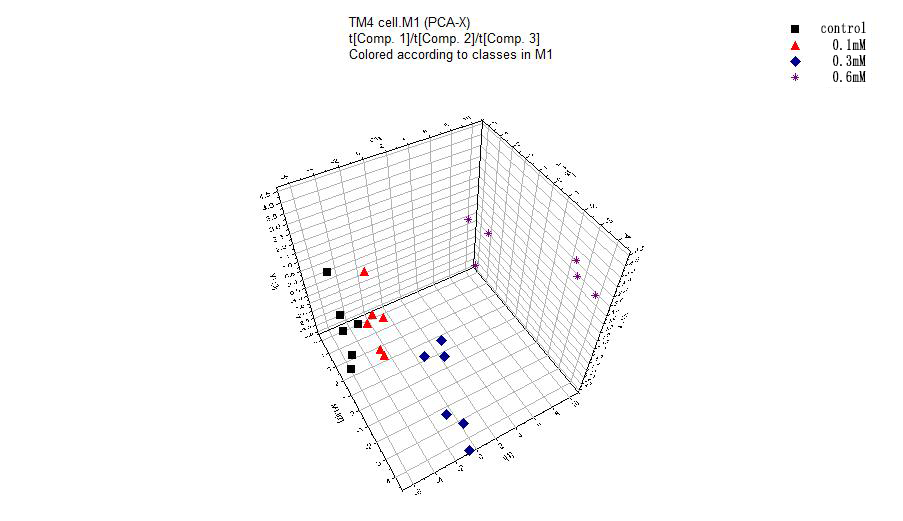
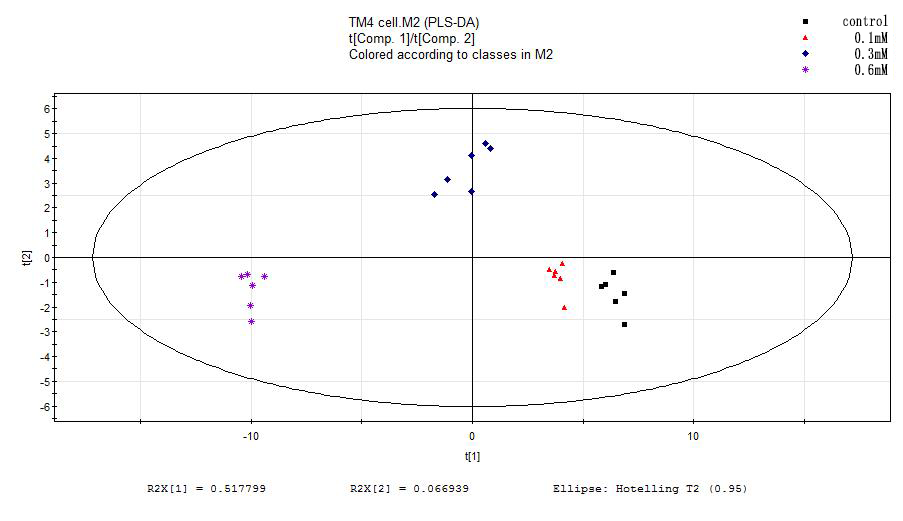
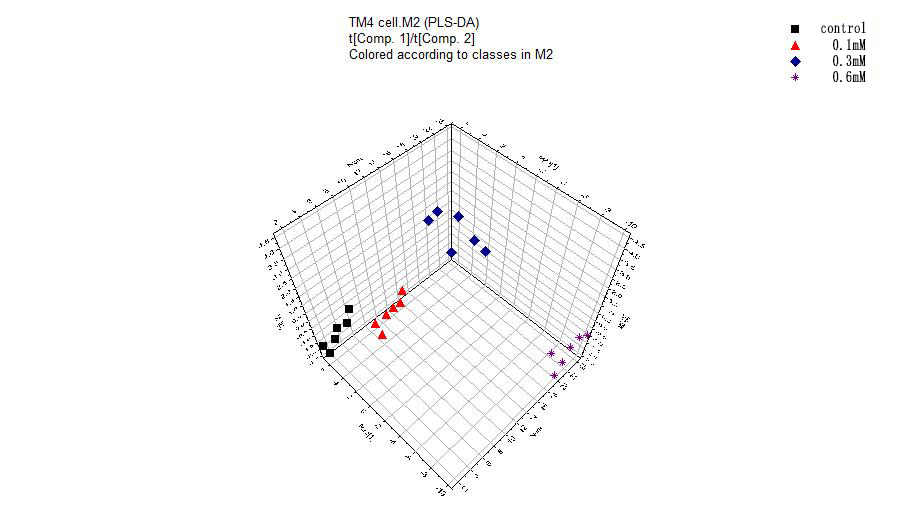
MTT实验结果表明,随着H2O2浓度的增加、作用时间的加长,细胞的存活率越低。AnnexinV-FITC/PI双染实验的结果表明,细胞的凋亡对H2O2有浓度依赖性。ROS检测结果表明,实验组相对于正常组的ROS含量递增,且300μM和600μM的H2O2处理的实验组比对照组有显著性的差异。通过建模,证实了各实验组和对照组之间的样本有明显的分离趋势。选择VIP值(gt;1),t检验(Plt;0.05)和fold change值(gt;1.2),我们筛选出了12种化合物作为差异代谢物
结论:这些代谢物的代谢途径直接或间接的反应了支持细胞的氧化应激机制。
关键词:过氧化氢 睾丸支持细胞 氧化应激 代谢组学 GC-MS
Metabolomics on Hydrogen Peroxide inducedSteroliCell Injurybased on GC-MS
Abstract
OBJECTIVE: To study metabolomics on the mechanism of oxidative stress injury induced by hydrogen peroxide insteroli cells based on GC-MS.
Methods: The oxidative stress was induced by TM4 cells with a certain concentration gradient. The cell viability was detected by MTT assay. Apoptosis rate was detected by Annexin V-FITC / PI double staining cell flow cytometry. Intracellular ROS levels, the TM4 cell injury model was successfully established. In order to analyze the correlation between metabolites, we used principal component analysis (PCA), partial least squares-discriminant analysis (PLS-DA) pairs, and the results were analyzed by GC-MS method. Data for modeling.
MTT results show that with the increase of H2O2 concentration, the longer the interaction time, the lower the survival rate of cells. The results of Annexin V-FITC / PI double staining showed that apoptosis was dependent on H2O2 in a concentration-dependent manner. ROS test results showed that the experimental group compared with the normal group ROS content increased, and 300μM and 600μM H2O2 treatment group compared with the control group were significantly different. Through the modeling, it was confirmed that the samples between the experimental group and the control group had obvious separation trend. We screened 12 compounds as differential metabolites (VIPgt; 1), t-test (P lt;0.05) and fold change (gt; 1.2)
CONCLUSIONS: The metabolic pathways of these metabolites directly or indirectly reflect the oxidative stress mechanisms that support cells.
Key words: Hydrogen peroxide;Steroli cell;oxidative damage;Metabolomics;GC-MS
目 录
摘 要 1
Abstract 2
第一章 文献综述 4
1.1支持细胞的形态结构特点 5
1.2睾丸支持细胞的功能 5
1.3睾丸支持细胞的研究进展 5
1.3.1支持细胞具有能够促进细胞生长的作用 5
1.3.2支持细胞的免疫屏障 6
1.3.3支持细胞的紧密连接的应用 6
1.4H2O2诱导睾丸支持细胞损伤的机制 6
1.5代谢组学 6
1.5.1代谢组学的定义与分类[16] 6
1.5.2细胞代谢组学的特点 7
1.6代谢组学分析流程 8
1.6.1样品的采集和预处理 8
1.6.2数据的采集 9
1.6.3数据预处理和多变量数据分析 10
第二章H2O2诱导睾丸支持细胞氧化应激损伤 11
2.1实验试剂与器材 11
2.1.1实验试剂 11
2.1.2实验器材 11
2.2实验内容 12
2.2.1细胞培养 12
2.2.2MTT法对细胞存活率进行检测 12
2.2.3AnnexinV-FITC/PI双染细胞凋亡—流式细胞术检测细胞凋亡 12
2.2.4细胞内氧化应激活性氧(ROS)水平检测 13
2.3实验结果 13
2.3.1MTT细胞检测 13
2.3.2AnnexinV-FITC/PI双染细胞凋亡结果 14
2.3.3ROS检测TM4细胞的存活率 14
第三章 TM4细胞氧化应激损伤的代谢组学研究 16
3.1实验试剂与器材 16
3.1.1实验试剂 16
3.1.2实验器材 16
3.2试验方法 16
3.2.1基于GC-MS方法学的建立与考证 16
3.2.2检测TM4细胞代谢物 17
3.2.3数据分析 18
3.3实验结果 18
3.3.1考察线性度、精密度 18
3.3.2总离子流色谱图 20
3.3.3主成分分析图(PCA) 24
3.3.4偏最小二乘法-判别分析 25
3.3.5差异代谢物 27
第四章 讨论与总结 30
参考文献 32
致谢 34
第一章 文献综述
支持细胞(steroli cell)是睾丸中弯曲细长的曲细精管上皮附着的细胞[1]。其中,曲细精管由支持细胞和各级生精细胞组成,支持细胞为生精细胞提供支撑、保护和营养支持[2]。
1.1支持细胞的形态结构特点
一般认为,支持细胞生长在曲细精管上部的整个生精上皮中,其细胞表面积巨大。支持细胞是第一个在胎儿的未分化性腺中识别出差异的细胞,然而在青春期开始时,支持细胞的形态和功能发生根本性变化,预示它着从不成熟的增殖状态转变为成熟的非增殖状态[3]。细胞核扩大并变成三部分,核仁变得更加突出,在光镜下以观察其超微结构,该细胞呈三角,圆锥形或不规则形态。相邻的支持细胞彼此形成紧密连接以形成独特的腺内腔,在这里可以进行精子发生的减数分裂和减数分期后期步骤。因此,在腺内腔室中发育的生殖细胞被有效地密封,而无法与许多营养物质直接接触,只能依赖于通过支持细胞分泌这些因子。
1.2睾丸支持细胞的功能
支持细胞包围着生精细胞,对它们提供结构性支撑和稳定的微环境,还为它的营养和发育提供所需的细胞因子[4],促使其完成生长和分化。支持细胞能参与精子的发生过程,若没有支持细胞的物理和能量上的支持,也就不会发生生殖细胞的分化,减数分裂以及转变成精子的过程[5]。此外,支持细胞还在数量上决定了精子生产的程度。
支持细胞还具有分泌蛋白酶、生长因子、激素类、能量底物的功能[6]。它在卵泡刺激素和雄激素的作用下,生成雄激素结合蛋白(androgen binding protein),该蛋白可与雄激素结合后,维持生精小管内雄激素的水平,促进精子发生[7]。
相关图片展示: