晶体硼化物作为析氢反应催化剂研究毕业论文
2020-02-13 17:31:23
摘 要
硼化物作为一种电极材料因其低成本和高电化学性能的特点,在电化学催化领域受到人们广泛的关注,而现有研究主要围绕非晶态硼化物展开,本文意在探究晶态硼化物催化材料并研究其催化性能.
本文使用Ni(OH)2作为镍源,NaBH4作为硼源,采用固相反应法在不同温度下成功制备合成晶态NiB。利用X射线衍射图谱法,光电子能谱法,电感耦合等离子体质谱法,透射电镜,验证其晶态特征,并通过线性扫描曲线等方法探究工艺温度对其催化性能的影响,主要研究内容和结果如下:
- 使用固相反应法,分别于300℃,400℃,500℃,600℃合成晶态NiB,对以上四种样品进行XRD和TEM图谱分析可知,合成温度为400℃时,结晶最为完全,晶体纯度最好。其结晶态为无规则结晶颗粒,晶相清晰,晶簇较为统一,晶面间距统一,为面心立方晶型。而当合成温度为500-600℃时,Ni和B一种Ni2B Ni3B4化合物的晶态形式存在,形式依然为晶态,且600℃时结晶更为完全。
- 对400℃摄氏度合成的NiB样品进一步进行XPS表面分析,发现NiB呈一种晶态合金,Ni和B均主要表现为0价。反应温度决定其合成产物价态以及形式,当温度不高时合成产物为0价合金,而温度超过500℃时产物则为变价化合物。
- 对以上四种材料进行扫描曲线测试其10mAcm-2电流密度下的过电势,探究发现当反应温度为400℃时合成的NiB合金催化剂的最优电流密度过电势最小,仅为182mV,性能最优。而当合成温度为300摄氏度时,产物仍为晶态合金,但结晶度不高,过电势为344mV,一定程度上说明对于晶态NiB 合金催化剂来说,其结晶完整度,纯净度与其催化性能正相关。
关键词 :晶体硼化物; HER催化剂; 水电解;非贵金属催化剂
Abstract
As an electrode material, boride has attracted much attention in the field of electrochemical catalysis because of its low cost and high electrochemical characteristics. Among them, existing research mainly focuses on amorphous boride. This paper intends to explore crystalline boride catalytic materials and study their catalytic properties.
Ni(OH)2 is used in this paper as nickel source, and NaBH 4 as boron source. The solid phase reaction is successfully used to prepare synthetic crystalline NiB at different temperatures. X-ray diffraction pattern, photoelectron spectroscopy, inductively coupled plasma mass spectrometry and transmission electron microscopy were used to verify the crystalline characteristics. The effects of temperature on the catalytic performance were investigated by linear scanning curves. The main research contents and results are as follows:
1. The solid phase reaction method was used to synthesize crystalline nibs at 300 ° C, 400 ° C, 500 ° C, and 600 ° C, respectively. X-ray diffraction and TEM analysis of the above four samples showed that when the synthesis temperature is 400 ° C the crystallization is most complete and the crystal purity is best. The crystalline state is irregular crystal particles, the crystal phase is clear, the crystal cluster is relatively uniform, and the interplanar spacing is uniform, which is a cubic crystal form. When the synthesis temperature is 500-600 ° C, the crystalline form of nickel and boron exist as Ni2B Ni3B4 compound, the form is still crystalline, and the crystallization is more complete at 600 ° C.
2. XPS surface analysis was carried out on the NiB sample synthesized at 400 ° C. It was found that NiB was a crystalline alloy, and both nickel and B were zero. The reaction temperature determines the valence state and form of the synthesized product. When the temperature is not high, the synthesized product is a zero-valent alloy, and when the temperature exceeds 500 degrees Celsius, the product is a variable-valent compound.
3. Scanning curves of the above four materials were tested for overpotential at 10 mAcm-2 current density. It was found that the optimum current density overpotential of the synthesized NiB alloy catalyst was only 182 mV when the reaction temperature was 400 °C. The performance is optimal. When the synthesis temperature is 300 ° C, the product is still a crystalline alloy, but the crystallinity is not high, and the overpotential is 344 mV. It indicates, to some extent, that there is positive correlation between the crystal integrity, purity and catalytic performance of the crystalline NiB alloy catalyst.
Key words : Crystalline boride catalyst; Water electrolysis; HER electro-catalyst; Non-precious catalyst
目 录
第1章 绪论 8
1.1 研究背景 8
1.2 氢气简介 9
1.3 氢气的制备工艺 10
1.4电解水析氢反应机理 10
1.5电解水析氢反应装置 12
1. 6非贵金属水电解催化材料研究进展 13
1.6.1磷化物催化剂 13
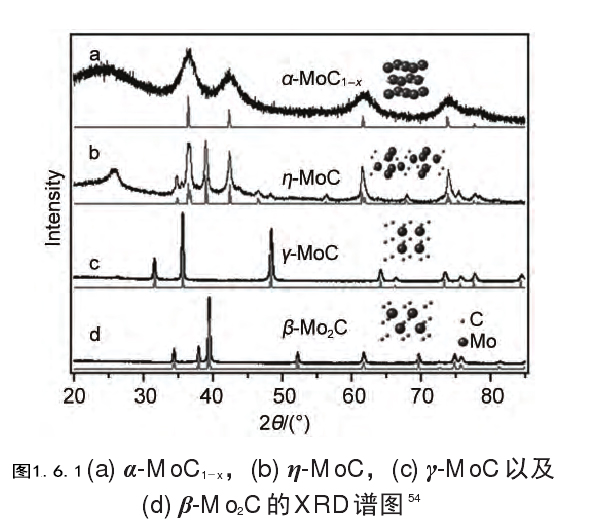
1.6.2碳化物催化剂 15
1.6.3 氮化物催化剂 16
1.6.4 硼化物催化剂 17
1.7 硼化物材料的分子结构 18
1.7.1非晶态硼化物 18
1.7.2晶态硼化镍 18
1.8本文研究目的 18
1.9本文研究内容 19
1.10 本文所用到测试方法 19
X射线衍射法(XRD) 19
X射线光电子能谱(XPS) 20
透射电子显微镜(TEM) 20
电感耦合等离子体质谱法(ICP-MS) 20
线性扫描曲线 20
耐久性测试 21
1.11实验仪器和试剂 21
第二章 实验方法 23
2.1NiB 合金的制备 23
2.1.2高温固相反应法合成晶态NiB 23
2.2 电极的组装 24
第三章NiB 合金结构和性能的表征 25
3.1不同温度合成Ni-B粉体的(XRD)物相分析 25
3.2 Ni-B合金(ICP)元素组成 26
3.3 Ni-B合金(XPS测试)表面结构和物质组成 26
3.4不同工艺温度制备Ni-B的LSV分析 27
3.5 NiB合金的晶体结构分析 28
3.6 NiB合金催化剂电化学耐久性测试。 30
第四章 结论 31
参考文献 32
致 谢 34
第1章 绪论
1.1 研究背景
从人类社会诞生以来一直伴随着能源的发展与更迭,从原始社会的木柴到工业社会的煤炭等化石能源,人类社会历经几次能源革命,都对其本身发展起到了至关重要的作用。当前,化石燃料在人们生产和发展过程中被过度的开发和使用,不但造成环境恶化,全球变暖和温室效应,还使人们面临各种自然资源枯竭的困境。
在目前研究技术背景下,像太阳能、风能、核能、地热能等这样的新型供能方式不断开发。但是,它们的能量转换效率目前而言并不是很高,通常还会受到环境和地域因素限制。在当前人类社会的能源结构中,新能源转化的最终形式为电能。按照当有发电模式——“即发,即送,即用”,在外界用电负荷较低情况下,不能送出的电能将会使发电机发热,引起发电机的故障。此时,我们需要高效的电能储存设备存储转化电能,以备不时之需。电能有很多种储存方式,包括机械储能、电磁储能、相变储能和化学储能等。其中化学储能使用最为方便,应用最为广泛,同时造成的环境污染相对较少,不受外界环境因素的限制,在能量转换上(燃料电池)不受卡诺循环限制,具有较高的转化效率、比能量密度和比功率密度等优点。
化学储能的终极形就是氢体系燃料电池储能,它利用氧化还原反应过程中的电荷转移形成的定向电流,可以组建成原电池,将体系的化学能以电能形式释放,唯一的排放物是水,真正实现零污染,在军事,航空航天等领域的特殊情况下还能解决用水问题。除此之外,燃料电池的能量转化效率高,供能稳定,环境友好,小型化,模块化,燃料补充效率远高于二次电池。因其独特的优势,它在许多领域得到发展,特别是在新能源汽车、通信供电等领域有着广泛的应用前景,成为未来能源革命的中流砥柱力量。
此外,化石燃料价格不断上涨,环境问题愈发严重,燃料电池汽车,氢能源循环的使用成为改善现状、实现科学发展的有效措施。然而其核心燃料氢气,因制备困难,制备成本高等问题,已无法满足当前迅速发展的市场需求。所以,寻求一种安全可靠、性能高、成本低、环境友好的氢气制备工艺方法成为目前研究的重要课题。而水电解催化制备体系恰好满足这方面的要求,它所展现出的广阔研究及应用前景,受到各国科学家的密切关注。
1.2 氢气简介
氢被认为是一种清洁的能源,正在发展成为一种低碳和无碳的能源。 21世纪,中国和美国,日本,加拿大,欧盟等都制定了氢能发展计划,而中国在不久的将来在氢能领域取得了很大进展,氢能发展计划是氢能领域的主导应用之一,它们也被国际社会公认为氢燃料电池和车辆工业化的最可能的先驱。
世界正在开发新的能源,由于使用石油,天然气,煤炭等能源,石油气是不可再生资源的财产,地球上的有限储备是紧迫的,人类的生存和发展不能没有能源,现如今随着化石燃料消耗的增加,其储量逐渐减少,有朝一日这些资源,能源将被用尽,有必要寻求新的能源。人们迫切需要找到对化石燃料的依赖的取代方案,发展富含新能源的新能源技术储备。氢是一种新的二次能源,随着传统能源危机的出现和新的二次能源的发展而出现在人们视野中。
氢位于元素周期表的顶部,原子序数为1,在常温常压下为气态,在极低温和高压下为液态。作为理想的新能源,它具有以下特性[1]:
最轻:标准状态,密度为0.0899g / l,当-252.7℃时,可以是液体,当压力增加到几百个大气压时,液态氢可以变成金属氢氧化物。[2]
丰富:据估计,它占宇宙质量的75%,主要以化合物的形式储存,化合物是地球上最丰富的物质,在水中。据估计,回收海水中的所有氢气产生的热量是地球上任何化石燃料的9000倍。
回收:氢气在燃烧过程中释放的排放物只是水,因此可以分解和回收利用。
理想的热值:是除了核燃料热值外,所有化石燃料中热值最高的,是汽油热值的三倍。
燃烧性能好:点火速度快,与空气混合时点火范围大,燃点高,燃速快,不产生二氧化碳,化石燃料燃烧生成的碳氢化合物和铅化合物尘埃颗粒和其他有害环境有害的物质,而燃烧氢气可以不断产生水,反复循环利用。产品水无腐蚀性,不损害设备。
使用方法多样化:热能可以通过燃烧,热机中的机械功产生,也可以作为燃料电池能量的材料或转换成固体氢作为结构材料。
不同形式:气态,液态或固态金属氢化物适应不同存储和应用环境的不同要求。
高利用率:氢燃烧发动机和噪声源,消除能源污染问题,高利用率。
便利的运输:氢气可以减少运输燃料所需载具,增加有效载荷,运输成本降低可以提高整体社会效益,因而使运力充分利用。
1.3 氢气的制备工艺
当前,现代工业制备氢气主要分为三种方法[3]:甲烷蒸汽重整、煤碳气化和电解水制氢,而其中绝大多数的氢气是通过甲烷蒸汽重整和煤碳的气化制备的,电解水法的使用却因其高耗能,工艺不成熟而极其有限(小于等于4%) 。归根结底当前广泛运用的制氢方法仍然依赖于传统化石燃料。以化石燃料为基础的化工制氢技术并不能形成一种环境友好的能源循环系统,反而加重了环境污染和温室气体排放造成的全球变暖。因此,以消耗化石能源为手段的制备氢气工艺违背了我们的初衷。
在未来,唯一可持续的生产氢的方法是电解水。 它的电解耗能来自太阳能和风能等可再生能源为代表的清洁电力的驱动。 事实上,世界上正在积极开发太阳能,风能等清洁能源技术,为水电解技术的发展提供了良好的基础。 风能技术的局限性是间歇性和不可预测的,由于夜间需求低,浪费了太多的风能的问题。
对H2电解的迫切需求激发了对电解水装置[4]
H2O(1)→ H2(g) 1 / 2O2(g),Delta;G0 = 237.2kJ mol-1,E0 = 1.23V
与氢电极深入研究的兴趣。这种方法具有许多优点,例如使用水作为起始材料,不排放温室气体和其他污染气体,有较高的氢生产效率和较高的单质纯度,水的电解被认为是生产H2的清洁且有效的方法。
因为受到工业成本的限制,电解实验几乎不可能在理论分解过电位(电压)下进行。 由电极直接极化引发的过电位开始电解反应需要非常多的能量。 所以电解反应中实现低过电位对的关键是高效率的电催化剂。
用于析氢反应的最著名的有效电催化剂是Pt和Pt金属,其过电势接近于零。 然而,这些贵金属催化剂由于其稀缺性和高价格而受到限制。 因此,迫切需要开发非贵金属电催化剂,例如镍基合金,金属硫属元素化物,碳化物,硼化物和氮化物,以及新开发的复合材料非金属催化剂。 非贵金属电催化剂引起了研究人员的极大关注。
1.4电解水析氢反应机理
水的电解总反应过程在体系由如下两个半反应构成,即阴极的析氢反应和阳极的析氧反应,具体反应形式取决于电解液的酸碱度
酸性条件下
4H 4e → 2H2(g) 析氢反应(HER)
2H2O(1)→ 4e 4H O2(g) 析氧反应(OER)
碱性条件下
2OH- -2e →1/2O2 H2O 析氧反应(OER)
2H2O(1) 2e →2OH-(aq) H2(g) 析氢反应(HER)
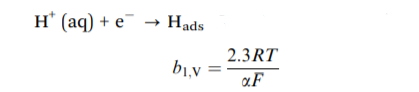 在酸性条件下,析氢反应为多步反应过程,有三个基元反应构成。第一步是放电过程,在该过程中,电子移动到阴极表面并捕获电解质中的质子,以形成吸附在催化剂表面的活性位点上的氢原子的中间状态
在酸性条件下,析氢反应为多步反应过程,有三个基元反应构成。第一步是放电过程,在该过程中,电子移动到阴极表面并捕获电解质中的质子,以形成吸附在催化剂表面的活性位点上的氢原子的中间状态
方程式中b是塔菲尔斜率,我们通常使用塔菲尔梯度来确定氢析出反应进行的路径,塔菲尔斜率表示当电流密度增加十倍时所需的电位差。通过将极化曲线(电流密度与电位)重新绘制为塔菲尔图,可以通过将塔菲尔图的线性区域拟合到塔菲尔方程来确定塔菲尔斜率,这是获得塔菲尔斜率值的最常用方法。 塔菲尔斜率的较小意味着增加相同的电流密度需要较小的过电位,这意味着更快的电荷转移动力学。alpha;是对称系数为0.5,T是绝对温度,F是法拉第常数,R是理想气体常数。
以下步骤有两种不同的方法来生成H2的最终产品。 当Hads覆盖率低时,优选吸附的氢原子与电解质中的新电子和其他质子结合形成 H2该电化学解吸步骤称为海洛夫斯基反应。[5]
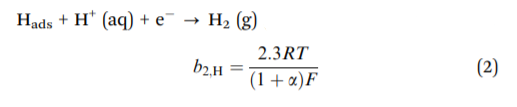
然而,在相对较高的Hads覆盖率下,相邻吸附氢原子之间的重组占主导地位,这被称为塔菲尔反应,也称为化学解吸步骤:
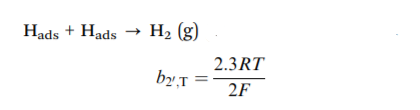
上述三个反应的塔菲尔斜率计算为b1,V = 118mV dec-1,b2,H = 39mV dec-1,和b2`,T = 29mV dec-1。 塔菲尔斜率是电催化剂的固有性质。 实际上,它是从塔菲尔图的线性部分的斜率获得的,其方程式如下所示:
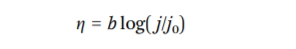
方程式中,j是电流密度,j0是交流电流密度,eta;是过电位。
交换电流密度是电极反应的固有特性,其仅取决于催化剂材料,电解质和温度。它反映了电子转移的能力和电极反应的难度。过电位的内在原因是交换电流密度。具有较大交换电流密度的电极反应需要较小的驱动力(较小的电流密度)来进行反应。例如,最着名的HER电催化剂:Pt,在0.5M H2SO4中具有约1times;10 -3 cm2的大交换电流密度。然而,当使用汞作为HER电催化剂时,交换电流密度可以在0.5M H2SO4中小至5times;10-13Acm2,显示出极差的HER活性。[6]
如果电催化剂的实验塔菲尔斜率为29mV dec-1,则表明海洛夫斯基反应(电化学解吸步骤)决定反应速率,并且由该电催化剂催化的析氢反应通过塔菲尔--海洛夫斯基机制进行。
1.5电解水析氢反应装置
如图所示,水电解装置单元包括阳极,阴极,电源和电解质四部分组成[7]。对电极施加直流电(DC)以维持电荷存储并且电子流出负极。电子被氢离子(质子)吸收,仅形成氢。在保持电荷平衡的过程中,氢氧根离子(阴离子)通过电解质溶液移动到阳极,其中氢氧根离子发射电子并且这些电子返回到DC电源的正极。
为了提高溶液的导电性,通常将由具有高迁移率的离子组成的电解质施加到电解装置中。其中,最常用的是氢氧化钾溶液和胶体,以避免由酸性电解质引起的大的腐蚀损失。镍是一种常见的电极材料,因为它具有高活性,易于使用和低成本[39]。在水电解制备氢气的实验过程中,氢离子向电池的阴极转移,氢氧根离子向电池的阳极转移。通过使用质子交换膜装置,可以分别在阴极和阳极上形成气体容器,并且可以分别收集残留在阴极和阳极上的氢气和氧气。分别在阴极和阳极上发生的半反应可写为:
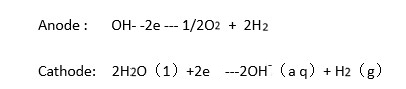
全反应为

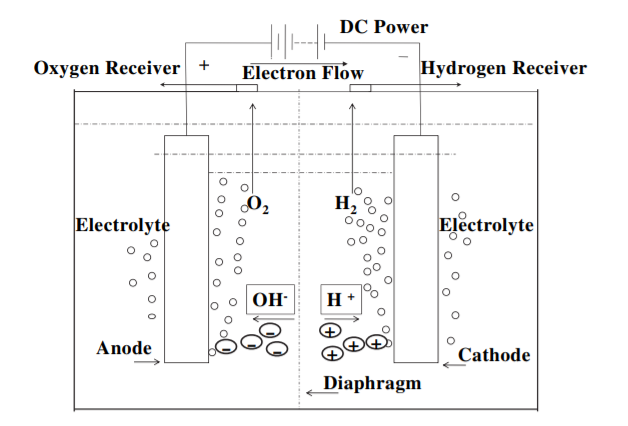 图1.4 水电解池示意图
图1.4 水电解池示意图
1. 6非贵金属水电解催化材料研究进展
1.6.1磷化物催化剂
过渡金属磷化物的在两百多年前就已经被人们所发现。然而关于其使用的记载却非常少,近二百年来没有发现过渡金属磷化物的显着使用。直到20世纪60年代,过渡金属磷化物逐渐应用于冶金,化工,农药,光催化降解,锂离子电池等领域。在早期,大多数金属磷化物的合成都必须经历了高温或高压,然而以可燃元素磷(P)作为磷源,使得实验难以进行且非常危险,除此之外P本身也具有很大的毒性,这极大地阻碍了发展和应用过渡金属磷化物材料。
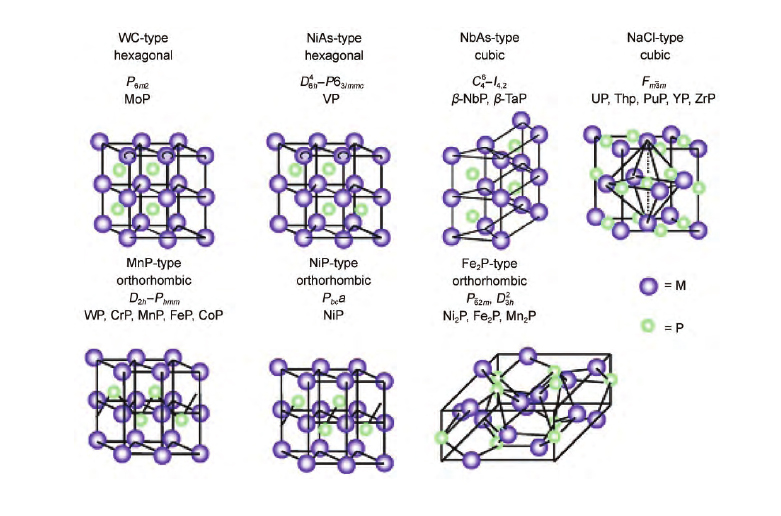
早期的研究表明,在室温下电沉积制备的无定形过渡金属 - 磷“合金”薄膜电极对析氢反应具有较高的活性[8]。当时人们推测这些电极的高催化活性源于在电化学制备过程中通过氢吸附调节的金属本身的电子结构,而不是催化剂本身[9-11],金属磷化物晶体结构如下图。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示:
您可能感兴趣的文章
- 单分散胶体CdSe和CdSe/CdS核/壳纳米晶体的两步合成策略外文翻译资料
- 沥青及沥青混合料产生的沥青烟的实验室评价外文翻译资料
- 溶胶凝胶法制备二氧化硅-氧化锆抗碱涂层外文翻译资料
- InAs/GaAs量子点尺寸对能带结构影响研究毕业论文
- InAs/GaAs量子点垒层对能带结构影响研究毕业论文
- 应用于3500K热辐射源的热光伏电池研究毕业论文
- 高(010)活性晶面暴露的BiVO4晶体的合成、改性及其光催化性能研究毕业论文
- 多孔氮化碳(g-C3N4)的合成、改性及其光催化性能研究毕业论文
- C/Cu2ZnSnS4(CZTS)复合材料制备及其光催化性能研究毕业论文
- Bi2MoO6/Cu2ZnSnS4(CZTS)复合材料制备及其光催化性能研究毕业论文




