结肠癌靶向纳米给药系统的制备及体外释药研究毕业论文
2020-03-04 08:54:26
摘 要
结肠癌是一种发生于结肠部位的消化道恶性肿瘤。口服结肠靶向给药系统(OCSDDS)虽能将抗结肠癌药物传递至结肠,避免药物在胃和小肠处的释放和吸收,但对结肠病灶区缺乏选择性。为提高OCSDDS的选择性并降低毒副作用,本研究制备了谷胱甘肽(GSH)响应性靶向纳米给药系统,并对其相关性能进行了研究。主要工作和结论如下:
(1)制备了两亲性羧甲基壳聚糖接枝4-巯基苯甲酸缀合物(CMCS-g-MBA)。对其进行了红外和核磁表征。结果表明4-巯基苯甲酸(MBA)羧基与羧甲基壳聚糖(CMCS)氨基反应形成了酰胺键,即MBA接支至CMCS上。
(2)制备了二硫键交联的CMCS-g-MBA纳米粒。采用动态光散射仪(DLS)表征纳米粒的粒径,采用透射电镜(TEM)观察纳米粒的形态。TEM显示纳米粒具有110 nm的核壳结构;DLS表明纳米粒能响应缓冲溶液的pH值和GSH浓度刺激而发生粒径变化。
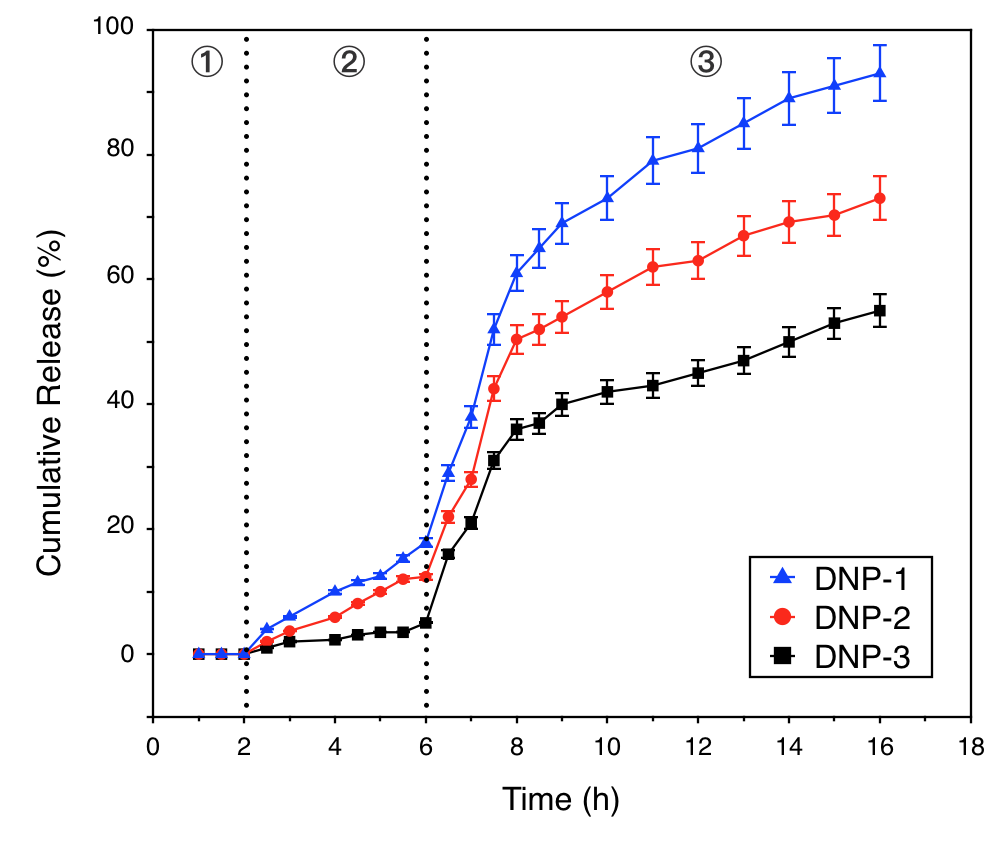
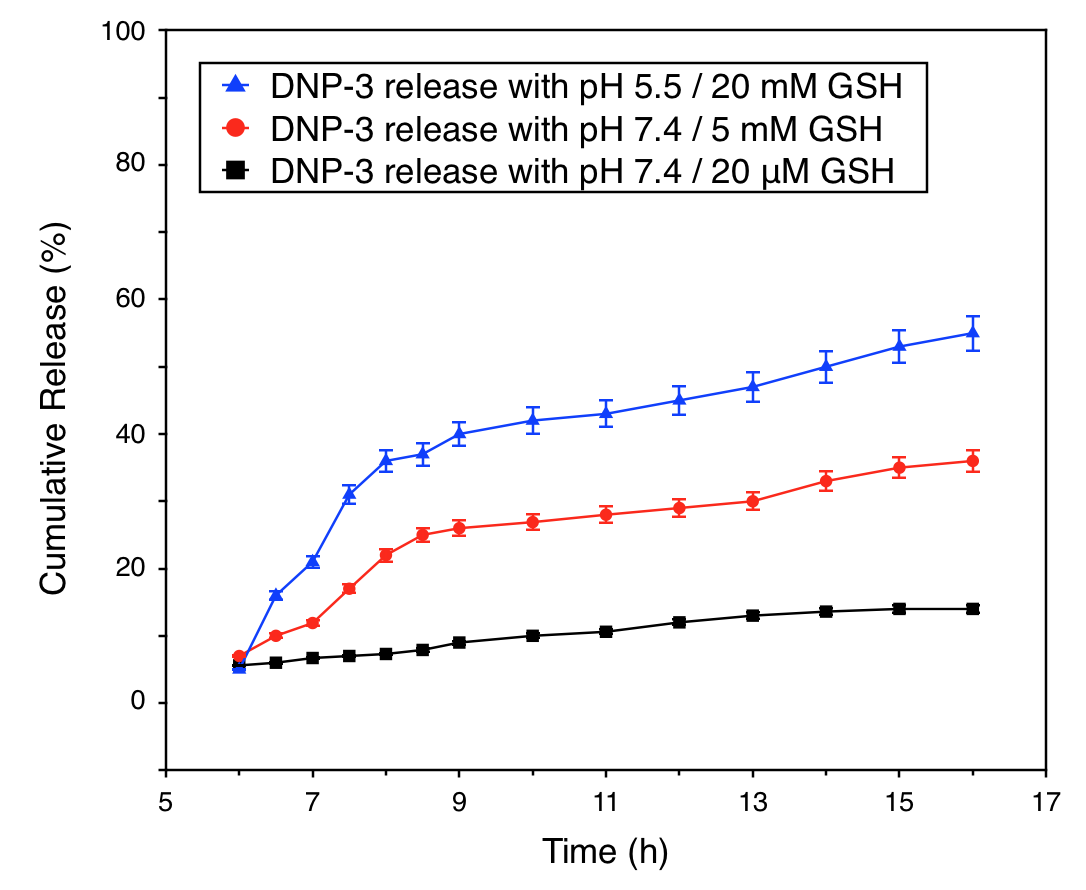
(3)研究了以卡莫氟(HCFU)为模型药物的载药纳米粒在不同环境中的释药情况。在模拟的胃部环境中,载HCFU纳米粒不释放药物;在模拟的小肠环境中,载HCFU纳米粒释药随交联程度的增大而降低,通过调节交联程度可避免或减少纳米粒内部的药物被提前释放。在含有微摩尔级GSH浓度的缓冲溶液中,纳米粒释放药物的速率明显加快,释药程度显著提高。显示出该粒子可用于靶向递送药物至结肠部位癌细胞的潜力。
关键词:结肠癌靶向;二硫键交联;pH敏感;还原响应;控制释放
Abstract
Colon cancer is a common gastrointestinal malignancy that occurs in the colon. Although Oral Colon Specific Drug Delivery System (OCSDDS) can deliver anti-colon cancer drugs to the colon to avoid drug release and absorption in the stomach and small intestine, it lacks selectivity for colonic lesions. In order to improve the selectivity of OCSDDS and reduce the toxicity and side effects, a glutathione (GSH)-responsive targeted nano drug delivery system was prepared and the related properties were studied. The main work and conclusions are as follows:
(1) An amphiphilic carboxymethyl chitosan-graft-4-mercaptobenzoic acid conjugator (CMCS-g-MBA) was prepared. It was characterized by infrared radiation (IR) and nuclear magnetic resonance (NMR). IR and NMR spectra showed that MBA was successfully grafted onto CMCS.
(2) Disulfide-crosslinked CMCS-g-MBA nanoparticles were prepared. The dynamic light scattering (DLS) was used to characterize the particle size of the nanoparticles. Transmission electron microscopy (TEM) was used to observe the morphology of the nanoparticles. TEM studies showed that the nanoparticles have a core-shell structure of 110 nm; DLS studies showed that the nanoparticles can change their size in response to the stimulation of pH value of buffer solution and GSH concentration.
(3) The release of drug-loaded nanoparticles using carmoful (HCFU) as a model drug in different environments was studied. In the simulated gastric environment, the HCFU-loaded nanoparticles did not release the drug; in the simulated small intestine environment, the drug release from HCFU-loaded nanoparticles decreased with increasing degree of cross-linking, and premature release of internal drugs could be avoided or reduced by adjusting the degree of cross-linking. In the buffer solution containing micromolar-level of GSH, the release rate of the drug from the nanoparticles was significantly increased, and the drug release was significantly increased. These nanoparticles were shown to be useful for the targeted delivery of drugs to cancer cells.
Key Words: Colon cancer targeting; disulfide bond cross-linking; pH sensitivity; reduction responsive; controlled release.
目 录
第1章 绪论 1
1.1 结肠癌概述 1
1.2 口服结肠靶向给药系统概述 1
1.2.1 口服结肠靶向给药系统的概念 1
1.2.2 口服结肠靶向给药系统的分类 1
1.2.3 纳米级结肠靶向给药系统的研究进展 1
1.3 聚合物纳米粒子概述 2
1.3.1 聚合物纳米粒子的概念 2
1.3.2 基于羧甲基壳聚糖的两亲性聚合物自组装纳米粒的研究进展 2
1.4 pH敏感性聚合物纳米粒子概述 3
1.4.1 pH敏感性聚合物的概念 3
1.4.2 pH敏感性聚合物纳米粒子的研究进展 3
1.5 谷胱甘肽响应性聚合物纳米粒子概述 4
1.5.1 谷胱甘肽的概念 4
1.5.2 谷胱甘肽响应性聚合物纳米粒子的研究进展 4
1.6 本文的设计思路及主要研究内容 5
第2章 CMCS-g-MBA的制备及表征 6
2.1 引言 6
2.2 实验部分 6
2.2.1 实验试剂和实验设备 6
2.2.2 CMCS的制备 7
2.2.3 CMCS-g-MBA的制备 7
2.2.4 红外光谱表征 7
2.2.5 1H-NMR表征 8
2.2.6 巯基含量测定 8
2.3 结果与讨论 8
2.3.1 CMCS的制备 8
2.3.2 CMCS-g-MBA的制备 8
2.3.3 红外光谱解析 9
2.3.4 1H-NMR谱解析 10
2.3.5 巯基含量分析 10
2.4 结论 11
第3章 二硫键交联纳米粒的制备及性能研究 12
3.1 引言 12
3.2 实验部分 12
3.2.1 实验试剂和实验设备 12
3.2.2 二硫键交联纳米粒的制备 13
3.2.3 二硫键交联纳米粒的形态表征 13
3.2.4 二硫键交联纳米粒的pH敏感性研究 13
3.2.5 二硫键交联纳米粒的还原响应性研究 13
3.3 结果与讨论 14
3.3.1 二硫键交联纳米粒的形成原理 14
3.2.2 二硫键交联纳米粒的形态分析 14
3.2.3 二硫键交联纳米粒的pH敏感性分析 15
3.3.4 二硫键交联纳米粒的还原响应性分析 16
3.4 结论 16
第4章 载药纳米粒的体外药物释放研究 17
4.1 引言 17
4.2 实验部分 17
4.2.1 实验试剂和实验设备 17
4.2.2 载HCFU纳米粒的制备及载药率测定 17
4.2.3 载HCFU纳米粒的体外药物释放研究 18
4.3 结果与讨论 19
4.3.1 载HCFU纳米粒的制备 19
4.3.2 载HCFU纳米粒的体外药物释放分析 19
4.3.3 载HCFU纳米粒的释药机理 20
4.4 结论 21
第5章 结论 22
参考文献 23
致谢 25
第1章 绪论
结肠癌概述
结肠癌是一种消化道恶性肿瘤,其发病率为恶性肿瘤中第三位[1]。目前针对结肠癌的治疗方法以手术治疗为主,化学药物治疗为辅。化疗能够降低术后复发率、延长患者生存期。并且对于不能手术或已存在癌细胞转移的晚期癌患,化疗是唯一能够延缓病变的方法。然而目前用于治疗结肠癌的药物(如卡莫氟、多柔比星等)均易在正常组织蓄积,导致其存在毒副作用大、生物利用度低、选择性和靶向性差等缺点,同时给患者带来服药的不便和痛苦。因此,开发在结肠病灶部位定向释放抗肿瘤药物的新型给药系统,对于提高药物靶向性、减少给药剂量、降低毒副作用,从而提高治疗效果、改善患者生活质量和延长生存时间有重要意义。
口服结肠靶向给药系统概述
口服结肠靶向给药系统的概念
口服给药作为药物治疗中最常见的给药方式,对于患者具有方便、无痛和顺应性好等优点。但普通口服制剂通常在胃和小肠部位被释放、吸收,到达结肠部位的药物量相对较小,从而导致作用于结肠部位药物的治疗效果不理想。口服结肠靶向给药系统(Oral Colon Specific Drug Delivery System, OCSDDS)是一种在20世纪80年代被提出的新型药物递送系统。OCSDDS能够有效减少口服药物在胃和小肠部位的释放、提升其在结肠部位的释放率,从而发挥局部治疗作用[2]。与其它递药系统相比,OCSDDS还具有降低药物胃肠刺激性、增加药物生物利用度等优点[3]。
口服结肠靶向给药系统的分类
OCSDDS主要是根据结肠的生理学特征来进行设计。结肠的主要生理学特点如下[4]:(1)消化道自胃到结肠pH逐渐升高。胃的pH最低,一般在1.0-2.2,而结肠的pH最高,一般在6.5-7.5;(2)消化道内容物在结肠中的滞留时间较长,一般停留2-3天;(3)结肠中微生物菌群含量丰富并产生大量酶,如β-葡萄糖苷酶、偶氮还原酶等;(4)消化道内容物由于结肠内水分较少而较为粘稠,所受压力大。
根据上述不同生理学特点,研究者设计出不同释药原理的OCSDDS,主要为pH依赖型、时间依赖型、酶依赖型和压力依赖型等[2]。这些系统属结肠组织靶向系统,对结肠组织的病灶区不具有识别功能,尤其是对病变细胞不具有选择性。
纳米级结肠靶向给药系统的研究进展
常规OCSDDS受个体因素(如食物、病理生理等)的影响较大,导致其靶向功能不尽如人意。特别是伴有结肠炎症患者的消化道pH值、肠道菌群和肠黏膜完整性等生理条件均可能发生明显改变[5],这会对药物在病灶区的聚集和细胞摄取造成不利影响。
针对肿瘤组织特点,普遍认为制备负载抗癌药物的纳米粒子并减少其粒径是提高药物肿瘤靶向性的重要手段[6]。由于肿瘤组织表皮存在高渗透长滞留(Enhanced permeability and retention, EPR)效应,纳米粒易在肿瘤组织中富集并不被淋巴液回流消除[7]。纳米尺度的OCSDDS还可经胞吞作用绕过与P-gps(渗透性糖蛋白)的相互作用直接将药物递送至胞内,以增加其生物利用度。另外,利用靶向分子和刺激响应性基团对纳米级OCSDDS进行修饰,可使其特异性响应于靶组织,从而提高靶点处药物浓度[8]。目前OCSDDS载体主要为脂质体、胶束、水凝胶和二氧化硅纳米粒等。
Sun等人[9]设计制备了pH依赖型纳米级OCSDDS,该系统由聚丙烯酸树脂Eudragit®构成,研究结果显示通过改变聚酯侧链组成可以调控药物在不同pH范围内的结肠部位释放。Makhlof等人[10]利用PLGA和Eudragit® S100制备共混聚合物纳米粒(260-290 nm),并在结肠肿瘤模型中研究了负载布地奈德的pH敏感纳米粒的释药情况。体内实验表明负载布地奈德的纳米粒子相较于经常规肠溶包衣微粒(1.97±0.78 μm)具有更好的治疗效果及肿瘤组织粘附性。
Vong等人[11]设计了一种由两亲性嵌段共聚物甲氧基聚(乙二醇)-b-聚(4- [2,2,6,6-四甲基乙基哌啶-1-氧基]氧基甲基苯乙烯)(MeO-PEG-b-PMOT)组成的氧化-还原敏感性纳米粒子(RNPO)。该共聚物的疏水部分具有稳定的氮氧自由基,可以清除活性氧簇(ROS)。当口服RNPO后,其会在结肠粘膜中高度积累,然后内化于癌组织中。由于RNPO具有清除ROS的能力,故可显著抑制肿瘤生长。
聚合物纳米粒子概述
聚合物纳米粒子的概念
两亲性聚合物经分子间的氢键、静电相互作用和范德华力等驱动力自发地构筑成胶体大小的有序聚集体,称为聚合物胶束。聚合物胶束的形状多样,其中以疏水基团为核、亲水基团为壳的“核-壳”状球形最为常见,此外还有囊状、棒状、层状和星状等。球状聚合物纳米胶束不仅具有独特的性质,如优异的流体动力学特征和良好的动态稳定性。而且易于改性的表面性质能使其免于单核巨噬细胞系统(Mononuclear phagocyte system, MPS)的吞噬和网状内皮系统(Reticuloendothelial system, RES)的摄取,可达到改善药物代谢动力学特征、延长其半衰期并将药物特异性运输到靶组织的目的[12]。另外,聚合物胶束作为载体,药物可以不通过任何化学反应被包载到系统中,使得其活性不发生改变[13]。所以聚合物胶束已广泛用于药物传递系统的设计中以实现对癌症等疾病的靶向治疗。
基于羧甲基壳聚糖的两亲性聚合物自组装纳米粒的研究进展
壳聚糖(Chitosan, CS)又称脱乙酰甲壳素,是一种应用广泛的天然高分子材料。其具有良好的生物官能性、血液相容性和微生物可降解性,因此可被用作药物或基因治疗的载体材料[14]。但由于壳聚糖存在–OH、–NH2等基团,内部氢键作用较强,导致其结晶度高而不能溶解于水和大多数有机溶剂中,其应用受到很大限制。
羧甲基壳聚糖(Carboxymethl chitosan, CMCS)是壳聚糖羟基经羧甲基化后所得的一种衍生物。其保留了壳聚糖的良好生物学性能,又因羧甲基的引入而使其结晶度降低,从而极大改善了水溶性。羧甲基壳聚糖作为一种两性高分子聚电解质,其所含–COO–降低了–NH2的电荷密度,使其细胞毒性降低。故羧甲基壳聚糖还具有良好细胞相容性的特点。
由于上述优点,CMCS常被设计成两亲性羧甲基壳聚糖衍生物,且呈现出两种不同的设计思路:(1)将疏水性基团偶联到羧甲基壳聚糖分子链上。这种两亲性衍生物能在极性溶剂中自组装成“核-壳”状纳米粒子用于包载和运输药物;(2)将疏水性药物通过共价键连接至羧甲基壳聚糖骨架上,得到两亲性大分子前药,其在疏水作用力驱动下自组装形成大分子前药胶束用于靶向递送药物。
Tan等人[15]以叶酸(Folic acid, FA)作为修饰基团,制备了两亲性FA-g-CMCS聚合物,该聚合物在水溶液中可自组装形成纳米胶束。利用荧光光谱法和动态光散射法对FA-g-CMCS胶束进行了表征。结果显示该聚合物胶束在水溶液中的临界胶束浓度为9.34×10-2 mg/mL,均为球形且粒径约为110 nm。随后制备了包封多柔比星(DOX)的载药FA-g-CMCS粒子。模拟环境释药显示,该载药粒子能够持续释放DOX。体外细胞培养实验表明,由于內吞作用受到细胞膜表面叶酸受体的介导,叶酸修饰纳米粒的细胞吸收量高于亚油酸修饰纳米粒。因此载DOX的FA-g-CMCS纳米粒子对Hela细胞具有更高的细胞毒性,显示出其应用于递送化疗药物的潜力。
pH敏感性聚合物纳米粒子概述
pH敏感性聚合物的概念
pH敏感性聚合物是指随环境pH值变化而产生体积或形态变化的聚合物。研究表明,该类聚合物的pH敏感特性由氢键、范德华力、静电作用和疏水相互作用协同产生[16]。pH响应性机制通常为(1)高分子内部的弱酸(碱)性基团随介质pH值或离子强度改变而发生电离,使得聚合物内外离子浓度改变并导致氢键断裂,从而引起体积溶胀;(2)高分子内部易在酸(碱)性条件下水解的连接段随介质pH值改变而发生断裂,使得所连接的缀合分子脱离骨架链。
pH敏感性聚合物纳米粒子的研究进展
人体不同组织的pH值有所不同,消化道自胃(1.0-2.2)到结肠(6.5-7.5)pH逐渐升高。正常细胞内环境呈弱碱性(pH 7.4),而肿瘤组织中癌细胞具有较快的代谢速率,胞内糖酵解增加导致其内环境显酸性(pH 5.5)。消化道不同区段、正常和肿瘤组织的pH差异性均可应用于pH敏感性聚合物纳米粒子的设计中,通过引入pH敏感性基团或连接键,可使得载药pH敏感性聚合物纳米粒子在胃肠道不释放药物,而在具有特定pH值的结肠肿瘤细胞中释药,以达到肿瘤靶向作用。
Prasad等人[17]利用Eudragit® S100和壳聚糖制备了聚电解质复合纳米粒子(CsENP),用于抗癌药物7-乙基-10-羟基喜树碱的包封,其在结肠液中的响应性释药特征显示出可作为结肠癌治疗平台的潜力。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: