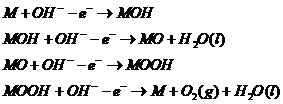碳基材料的掺杂改性制备及电化学催化性能研究毕业论文
2020-04-06 11:14:15
摘 要
目前,锂离子电池广泛应用于手机和笔记本电脑中,现在也在汽车行业中有所涉及,但其比能量不高已成为影响其发展的致命缺点。锂空气电池因具有较高的能量密度而引起人们的广泛注意,但缓慢的氧还原和氧析出速率反应限制了锂空气电池的发展。虽然贵金属催化剂能显著改善氧还原和氧析出反应,但是引用贵金属导致的高成本限制了锂空气电池的发展。碳基材料催化剂作为一种非贵金属催化剂,具有环境友好性、稳定性、抗腐蚀性和高效率等特点,成为锂空气电池催化剂研究的热点之一。
本论文研究采用环保无毒的多巴胺作为碳源,经高温热解后形成导电性良好的碳材料,探究不同PDA的浓度、乙醇与水的体积比、合成时间对聚多巴胺微观形貌的影响;再对聚多巴胺进行热解处理,探究掺杂金属离子浓度、煅烧温度和煅烧时间对聚多巴胺碳化的影响,利用旋转圆盘电极装置测试其电化学催化性能。
研究表明多巴胺浓度为1.0g/L,乙醇与水的体积比为1:4时合成的聚多巴胺微观结构为球形,形貌最佳;掺杂铁离子与多巴胺摩尔浓度比为1:16,在700℃下煅烧5h得到的催化剂电化学性能最好。
本文特色:通过研究不同合成和烧结条件,力求得到性能最优的金属离子掺杂碳基材料催化剂。
关键词:碳基材料;多巴胺;掺杂改性;煅烧;电化学性能
Abstract
At present, lithium cells are widely used in mobile phones and computers. Now they are also used in the automotive industry, but their low specific energy has become a fatal defect affecting its development. Lithium air batteries have attracted wide attention because of their high energy density. However, the slow oxygen reduction and oxygen release reactions restrict the development of them. Although noble metal catalysts can significantly improve oxygen reduction and oxygen precipitation reactions, the development of lithium air batteries is limited by the high cost of precious metals. As a kind of non precious metal catalyst, carbon based material catalyst has the characteristics of environmental friendliness, stability, corrosion resistance and high efficiency. It has become one of the hot spots in the research of lithium air battery catalyst.
This paper studies the use of environmentally friendly and non-toxic dopamine as a carbon source, after high temperature pyrolysis to form a good conductive carbon material and try to explore the effects of the concentration of dopamine, the volume ratio of ethanol to water, and synthesis time on the micromorphology of polydopamine. The influence of the concentration of doped metal ions, calcination temperature and calcination time on the carbonization of dopamine was also studied.
The results show that the best morphology is synthesized when the molar concentration of dopamine is 1.0g/L ,the volume ratio of ethanol to water is 1:4 and the microstructure of dopamine is spherical. In addition, when the ratio of iron ion to dopamine is 1:16 and the catalyst obtained by calcining 5h at 700℃ is the best.
This article features: through different synthesis and sintering conditions, we strive to get the best performance of metal ion doped carbon based materials.
Key Words:Carbon based materials;dopamine;doping modification;calcination; electrochemical properties
目 录
第1章 绪论 1
1.1锂空气电池 1
1.1.1锂空气电池原理 1
1.1.2锂空气电池的应用及发展 2
1.2析氧反应与氧还原反应 2
1.2.1析氧反应(OER)机理 2
1.2.2氧还原反应(ORR)机理 3
1.3氧还原反应催化剂 4
1.3.1贵金属催化剂 4
1.3.2碳基非贵金属催化剂 5
1.4本课题的立题意义和研究内容 5
第2章 不掺杂金属聚多巴胺(PDA)前驱体的制备 7
2.1实验原料与仪器 7
2.1.1实验原料 7
2.1.2实验仪器 7
2.2实验步骤 8
2.2.1不同多巴胺浓度对比 8
2.2.2不同乙醇与水的体积比对比 8
2.2.3不同合成时间对比 8
2.3多巴胺(PDA)球体的表征 9
2.3.1PDA的显微结构表征方法 9
2.3.2表征结果 9
第3章 金属掺杂前驱体的煅烧条件对电化学性能影响 12
3.1实验过程 12
3.1.1不同金属离子掺杂浓度对比 12
3.1.2不同煅烧温度对比 12
3.1.3不同煅烧时间对比 12
3.2碳基材料的表征方法 13
3.2.1物相表征 13
3.2.2电化学性能表征 13
3.3表征结果 14
3.3.1 SEM表征结果 14
3.3.2 XRD表征结果 15
3.3.2电化学表征结果 17
第4章 结论与展望 26
参考文献 27
致谢 28
- 绪论
随着科学技术和经济的持续发展,人们对能源的需求日益增加,目前常见的石油等不可再生资源供应远不及人们的生产生活需要,面临着稀缺的危险,并且各种能源的开发利用工程对环境或多或少的造成了一定伤害,人们非常急切地希望着研究出一种清洁而高效的能源,因此,用于替代不可再生资源的新型能源陈为了目前各地研究人员研究的重点。由相关研究已知,锂空气电池的理论比能量相当高,几乎可以与汽油的比能量相提并论[1]。现在已知的锂离子电池已经在电动汽车方面有广泛的投入使用,而作为比能量更高的锂空气电池如果能代替锂离子电池,电动汽车的效率将大大提升,因此,近十年,特别是最近几年,锂空气电池正在被广泛的研究。而作为影响锂空气电池效率的阴极催化剂,这几年也逐渐成为了研究的热门项目。
1.1锂空气电池
1.1.1锂空气电池原理
锂空气电池中,金属Li参与负极反应,空气中的氧气参与正极反应[2]。如图1.1所示,锂空气电池的正极发生还原反应,当空气中的O2接触阴极材料时,被吸附在电极表面,同时O2会得到电子生成OH-,电解质溶液中,OH-由于存在浓度梯度而通过被输送至到达负极;金属Li在负极发生氧化反应,失去的电子通过外电路到达正极形成回路,放电时具体电极反应如下:
正极反应:O2 (g) 4e- 2H2O = 4OH-
负极反应:Li - e- = Li
总反应: 4Li O2 (g) = 4LiOH
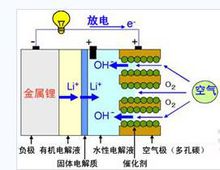
图1.1 锂空气电池的工作原理图
同理,充电过程中,阴极LiOH中的固态锂离子得到电子被还原成金属Li,并生成OH-,阳极附近的OH-失去电子被氧化成O2被析出,由于电极反应导致电解质溶液中出现了OH-的浓度梯度,阴极附近过剩的OH-通过碱性的电解质溶液被输送至阳极以到达浓度平衡,具体电极反应式如下:
阴极反应:LiOH e- = Li OH-
阳极反应:4OH- -4e- = O2 (g) 2H2O
总反应: 4LiOH = 4Li O2 (g)
1.1.2锂空气电池的应用及发展
现有的锂空气电池大概用电解质区分可以分为以下六种形式:全固态体系锂空气电池、有机-水双电解质体系锂空气电池、水体系锂空气电池、有机体系锂空气电池、离子液体锂空气电池和锂-空气-超级电容器锂空气电池[3]。由于锂空气电池阴极材料金属Li具有3.045V的电化学当量(相较于氢标准组),是所有金属中最小的,并且其氧化还原电位为0.260g/Ah,也是金属中最低的,因此拥有很高的能量密度。其值相较于锂离子电池高得多,也比汽油发动机的实际能量密度要高[4];而作为锂空气电池的正极反应物质的O2则可以轻松从电池周围大气中获得,综合以上两点考虑,锂空气电池在成为一种新的能源来源上有很大的发展前景。
大约在四五十年前,就有人在电动汽车的驱动动力研究中使用锂空气电池。Ford公司的Karulkar和Adams曾经尝试着将质子交换膜燃料电池模型中的双极板结构运用于锂空气电池[5],实验结果非常成功,实验所制得的锂空气电池拥有非常高的功率密度与能量密度,其理论比能量远远超过了美国先进电池联合体(USABC)所指定的电动汽车的相关标准。但是,由于初次使用双极板,基板材料的选择导致了该锂空气电池的成本较高。当下,Pt/C催化剂被认为是用于锂空气电池的理想催化剂[6],但同时也存在一些不足:首先Pt作为一种贵金属,资源非常稀有,价格也较其他金属高,其次在催化氧气还原反应时Pt的稳定性差,这些原因使得质子锂空气电池工业化发展受到了限制。因此,研发出催化效率高、成本低的新型氧化还原催化剂成为目前锂空气电池研究的热门项目。
1.2析氧反应与氧还原反应
1.2.1析氧反应(OER)机理
充电过程中,锂空气电池阳极发生的反应是析氧反应,该析氧反应并非一步完成,而是由多步中间过程一起完成,具体的反应机理如下[7]:
首先,M 与氢氧根离子接触使得氢氧根离子失去第一个电子形成第一个中间体MOH,MOH吸附在电极表面:接着,中间体MOH继续与氢氧根离子接触失去第二个电子形成第二个中间体MO并产生了水;MO继续接触氢氧根离子导致第三个电子的丢失形成第三个中间体MOOH;最后,中间体MOOH失去到四个电子使得化学键断裂重新生成M,并释放出氧气。
由析氧反应(OER)机理可知,氢氧根离子在失去电子生成氧气的过程大致可以分为四步进行,每一步失去一个电子,M物质先后生成了MOH、MO和MOOH三种中间体,最后有还原成M物质,因此可以推断出M物质是作为该氧析出反映的催化剂。M物质在反应前后的化学性质和质量都没有发生变化,也没有改变析氧反应的平衡,但大大加快了析氧反应的反应速度。
1.2.2氧还原反应(ORR)机理
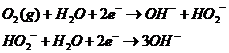 放电过程中,锂空气电池正极会发生氧还原反应,该氧还原反应有两种反应方式,第一种由两个步骤完成,两个个步骤都涉及两个电子的转移过程[8]:
放电过程中,锂空气电池正极会发生氧还原反应,该氧还原反应有两种反应方式,第一种由两个步骤完成,两个个步骤都涉及两个电子的转移过程[8]:
另外一种是一步完成,直接一次性转移四个电子:
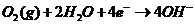
在第一种反应过程中,当氧气被吸附到正极时,先与水反应获得两个电子,生成了OH-和中间体HO2-,中间体HO2-进一步反应获得两个电子,生成三个氢氧根离子;第二种反应过程中,当氧气被吸附至正极时,直接获得四个电子生成四个氢氧根离子。
由氧还原反应(ORR)机理可知,当氧气进行四电子转移时,没有中间过程,反应速率影响不大,但当氧气进行双二电子转移时,生成和反应消耗中间体HO2-的速率对整个氧还原的速率起着至关重要的作用,因此,选择合理的催化剂来加快两步反应的电子转移速率能很大程度加快氧还原反应的反应速率。
1.3氧还原反应催化剂
在理想情况下,用于驱动电化学反应所要施加的电势会等于平衡电势,但实际情况时,当有电流通过电极时,实际施加的电势要大于平衡电势时,电化学反应才会顺利进行,实际施加电势与平衡电势的差值被称为过电势η。过电势的大小体现了需要克服电极动力学势垒的大小。根据能斯特方程[9]:

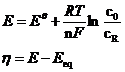
上式中:E——施加电势;
Eθ——形式电势;
F——法拉第常数;
T——绝对温度:
n——转移电子数;
R——气体常数
过电势的存在使得电极反应进行的能垒增强,导致电极反应速率降低,进而影响电池效率,因此,选择合理的电极催化剂来降低过电势,提高电池效率对锂空气电池的发展十分重要。
1.3.1贵金属催化剂
贵金属催化剂是一种由贵金属制得,自身的量不随化学反应变化但能显著加快反应速率的物质[10]。据研究发现,目前已知的贵金属大多能当做电极反应催化剂。Pt和Rh的使用在众多的贵金属中最多。这些贵金属之所以能用做催化剂是因为它们核外电子结构所致,首先其核外电子结构中d轨道电子未达到10个,易容纳电子,其次反应物易吸附在物质表面,可通过中间反应形成中间活性物,且形成和消耗活性物质的速率快,使得整体反应的速率加快,因此催化活性较高。与此同时这些金属还具有抗腐蚀、不易氧化、高温稳定等特点,成为最重要的催化剂材料。
贵金属催化剂是目前已知的催化剂中催化效率最高的催化剂之一,但贵金属催化剂由于开采条件限制,首先其成本较高,不利于大规模的生产投入,其次,这些贵金属的开采和使用可能会导致重金属的流失,对环境或多或少会造成一定的伤害,与推崇可持续发展的观念不符。因此,研究出一种效率高且清洁的氧还原催化剂对锂空气电池的发展有巨大的帮助。
1.3.2碳基非贵金属催化剂
炭黑材料具有良好的导电性能,且其稳定性好,可控性强,可以运用于电化学催化方面[11]。但纯碳材料本身没有有效的活性位点,对电化学催化能力不强,但对其进行表面改性后,其催化效率就会有很大的提升。
对于碳材料的改性有很多方法,最常见的就是对其进行掺杂。当对碳材料掺杂入N元素后,会形成很多无序结构,引入了大量的缺陷位点,这些缺陷位点会增加与反应物质的吸附能力,造成反应过程中更多分子的有效碰撞,从而及电子的转移,加快电极反应速率。
进一步对已掺杂N元素的碳材料再掺杂入非贵金属元素后,金属元素、N元素、碳材料三者间会形成金属-N螯合物结构,这种螯合物会引入更多的缺陷位点,且缺陷位点的活性更强,对吸附电极反应物质,调控电极反应速率有着至关重要的作用[12]。
1.4本课题的立题意义和研究内容
随着科学技术和经济的持续发展,人们对能源的需求日益增加,目前常见的石油等不可再生资源供应远不及人们的生产生活需要,面临着稀缺的危险,并且各种能源的开发利用工程对环境或多或少的造成了一定伤害,人们非常急切地希望着研究出一种清洁而高效的能源,因此,用于替代不可再生资源的新型能源成为了目前各地研究人员研究的重点。
锂空气电池近年来因为其较高的比能量密度和相对较高的效率成为了大型电动汽车驱动动力的主要研究热点。但是锂空气电池的效率受电极反应催化剂的限制,现已知的锂空气电池使用的电极催化剂常为Pt/C催化剂,这种催化剂虽然能对电池反应的效率有所提高,但Pt的年开采量少,成本高,导致锂空气电池的成本高,限制了锂空气电池的进一步发展,因此,研制出一种高效率低成本的电极反应催化剂成为了研究关键。
近年来,一大类碳材料负载或掺杂原子的催化剂因其优越的氧化还原性能而备受关注。在非贵金属氮掺杂催化剂中,M-Nx-C理论上是贵金属催化剂的最佳取代品[13],M-Nx-C具有高的化学稳定性与氧还原活性。研究发现多巴胺在碱性条件下几乎可以氧化聚合到所有材料的表面[14],多巴胺分子设计性强,可制得微观形貌不同的微纳米颗粒,实现表面功能化设计,实现大量活性位点引入。经研究已发现多巴胺能进行二次反应、与金属离子配位或无电沉积形成碳材料前驱体[15],再将前驱体通过高温热解可得到高导电性的碳基材料M-Nx-C,这种碳基材料催化剂具有非常高的电催化活性[16]。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: